2019年8月1日,“医耘沙龙”第一期在上海召开,围绕PARP抑制剂研究与投资机会,华医资本的创始合伙人曹锋博士及瑛派药业总经理包骏博士进行了主题分享,数十位投资人及业内专家参与讨论,对于PARP的投资价值进行了深度分析。
核心观点
PARP抑制剂适应症具有广阔扩展潜力
BRCA基因是PARP抑制剂的主要生物标志物(biomarker),对BRCA(胚系和体系)突变的患者,用PAPR抑制剂来进行治疗(特别是维持治疗)效果很好,虽然BRCA整体的患者群在相关适应症中只有5-10%,但是多个适应症的开发,将带来广阔的市场。PARP抑制剂已经在卵巢癌、乳腺癌、胰腺癌等相关适应症获批,前列腺癌也有不错的临床效果,肺癌、胃癌的适应症也在开拓中。
另外,PARP抑制剂(NOVA的III期)在非BRAC1/2突变的HRD和无HRD的卵巢癌中也有较好的效果,其他适应症中也在做非BRCA1/2突变的患者的临床试验,如果成功可以大大拓宽市场。
除此,如果有更多的生物标记物的发现(基础研究在不断探索),也会进一步拓展PARP抑制剂的市场。
已上市的PARP抑制剂药物效果差异不大进展速度是获得市场关键因素
从分子结构上来说,怎么样的药物效果更好,目前很难下定论,还是需要以临床结果为导向,有待更多临床数据。很难证实DNA TRAPPING的能力越强,就临床效果更好, DNA trapping能力低,可以用更大的剂量去弥补。从获批的适应症范围及现有数据,奥拉帕尼后面上市的三个药物也没有从临床疗效上赶超前者,而且目前来看依然是奥拉帕尼的安全性更佳。
对于正在临床的药物来说,在临床效果大致一样的情况下,还是速度为王。
现阶段国内上市PARP抑制剂药物竞争不大 2-3年后竞争格局会发生很大改变
2018年,奥拉帕尼进入中国,可以视为中国进入PARP抑制剂时代,目前为止,国内获批的PARP抑制剂仅此一款。但是医药魔方数据显示,尼拉帕尼已经准备在上市申请,豪森和百济神州在临床III期,瑛派在临床II期,因此接下来会陆续有PARP抑制剂上市。
另外,原研药的专利到期时间也是一个很重要的考虑因素。Rucaparib的核心专利于2020年过期,formulation的专利于2033左右过期,奥拉帕尼的核心专利于2024年过期,formulation的专利于2033过期。从药监官方数据查询,现还没有查到Rucaparib在中国仿制的临床报批,奥拉帕尼有一些仿制在申报临床。因此,专利保护力度肯定是下降的,在投资时专利这一点还需要再做进一步分析。
应用多个策略抢占药物开发先机
药物的机会可以从以下几个角度去考虑:
1. 以速度抢占先机,在适应症上抢先注册;
2. 现有的适应症上更好的临床效果;
3. 解决PARP抑制剂耐药,目前很多患者用了PARP抑制剂会耐药,不过由于现阶段耐药机制还不是很明确,企业可密切关注,等待机理相对明确时机;
4. 联合用药以实现临床突破,目前开展的比较多的是和PD-1联用以及和血管抑制剂联用,通过联合用药有望取得更好的临床获益。
因此,在评估公司管线时,要具体分析,着重关注企业的适应症是否有优势。
正文
全球共有4款PARP抑制剂上市,分别是奥拉帕尼(Olaparib)、鲁卡帕尼(rucatinib)、他拉唑帕尼(talazoparib)和尼拉帕尼(niraparib)。
2018年8月,奥拉帕利在中国获批上市,成为了国内首款小分子靶向PARP抑制剂。
在中国,PARP抑制剂已成为创新公司的热门研究领域,积极布局PARP抑制剂新药研发的企业不在少数,如再鼎医药、豪森药业、恒瑞医药、百济神州、瑛派药业等;涉及适应症包括卵巢癌、前列腺癌、乳腺癌、胃癌等;9款候选药已获批临床,3款已推进至临床3期。
PARP介绍
图表1:PARP大家族
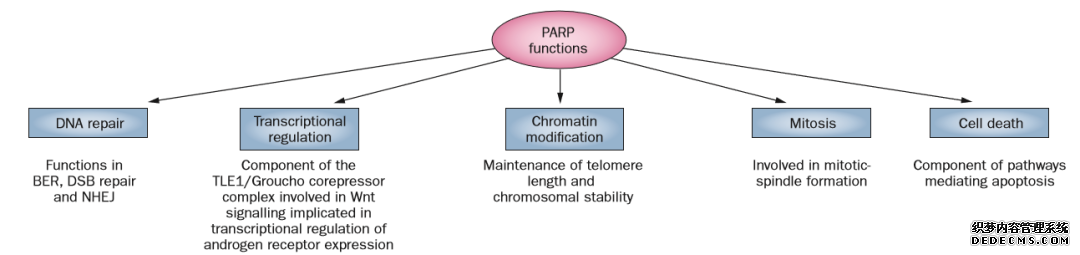
图片来源:文献[6],华医资本
PARP,全称The poly(ADP-ribose) polymerases,是一个超大蛋白酶家族,家族目前由18名成员组成,具有多种生物学功能,在DNA损伤修复、炎症调控、转录调控、信号转导、基因组稳定性、细胞周期以及有丝分裂等一系列广泛的细胞代谢过程中发挥着重要作用。
其中参与DNA 修复机制的有PARP1,PARP2和 PARP3。
PARP1 是 PARP 家族中最主要的成员,其在细胞中承担着 PARP 家族 90 %以上的功能,是 DNA损伤修复中的关键作用因子。除此之外,PARP家族中PARP-2也能准确识别单链断裂,发挥5%-10%的作用[13]。而对于同样在修复DNA损伤中发挥作用的PARP-3,还没彻底清楚其机制。
PARP1在DNA修复中承担着重要的功能(由于PARP1发挥着90%以上的作用,这里详细介绍PARP1,当发生单链断裂的时候,PARP-1作为DNA断裂的分子传感器,参与DNA的修复,具体如下:
图表2:PARP在单链断裂(SSB)修复起作用的途径
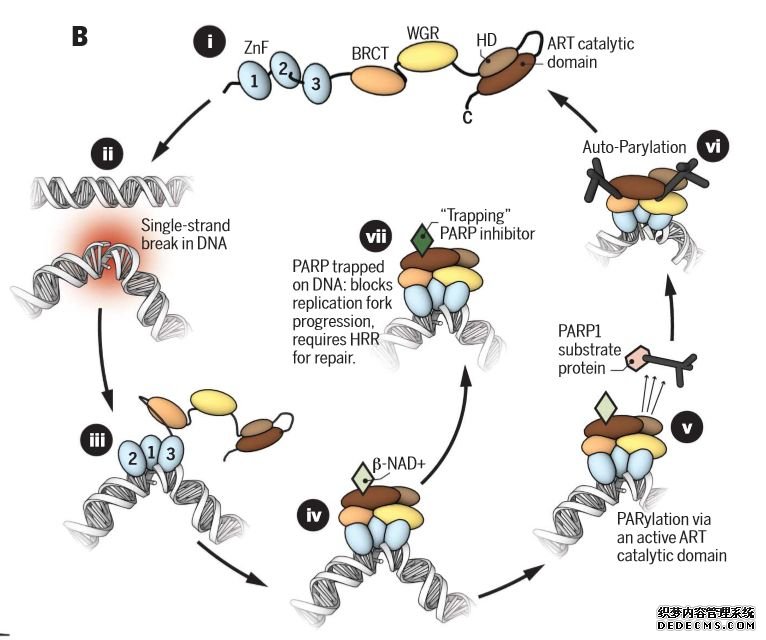
图片来源:文献[16],华医资本
I 在其非DNA结合状态下,PARP1以相对无序的构象存在,在这种非DNA结合状态下,HD充当自身抑制结构域,阻止PARP-超家族辅助因子b-NAD +与其ART结合位点结合
II DNA双螺旋损伤导致的SSB的形成
III PARP1的锌指结构域迅速识别并结合损伤位点
IV 与DNA的相互作用启动了剩余PARP1蛋白结构域逐步组装到PARP1 / DNA核蛋白结构上,这个过程导致HD构象的改变,并导致自身抑制功能的丧失,b-NAD +与其ART结合位点结合,从而变构激活PARP1催化活性
V 构想改变并激活酶活催化结构域,催化NAD+分解为ADP核糖和烟酰胺,然后以分解产生的ADP核糖为底物,对核受体蛋白(主要是PARP1自身,以及其他一些细胞核蛋白)聚ADP核糖化。这一修饰导致DNA损伤修复蛋白如XRCC1、DNA聚合酶和DNA连接酶3等迅速招募到损伤部位,进行修复
VI 修复后,解离下来的PARP-ADP聚合物在聚核苷二磷酸核糖水解酶(PARG)作用下被裂解,裂解后的ADP核糖可重新用于合成NAD+,而重新形成单体的PARP1/2可被再次激活。如此循坏作用于DNA损伤位点,完成DNA修复。
PARP抑制剂主要原理
由于PARP的活化主要是由于 β -NAD + 与其ART结合位点结合,因此目前上市以及在临床的药物主要的分子作用机理是通过与 NAD+竞争性结合 PARP 酶的催化域活性位点从而抑制 PARP 酶活性,使之不能通过形成 PAR 聚合物招募 DNA 损伤修复相关蛋白发挥作用。
最初,PARP1/2 抑制剂是作为化疗药物增敏剂而开发。
但是PARP抑制剂的真正高速发展来自有于2005年提出的“合成致死”的理论,可以理解为给PARP抑制剂一个精准的临床患者定位。
首先我们来看下合成致死的定义:如若两个基因之间存在合成致死作用,当其中任何一个基因单独受到抑制或发生突变时,细胞的生存不受影响,但同时抑制两个基因将导致细胞凋亡。
图表3 :“合成致死”原理
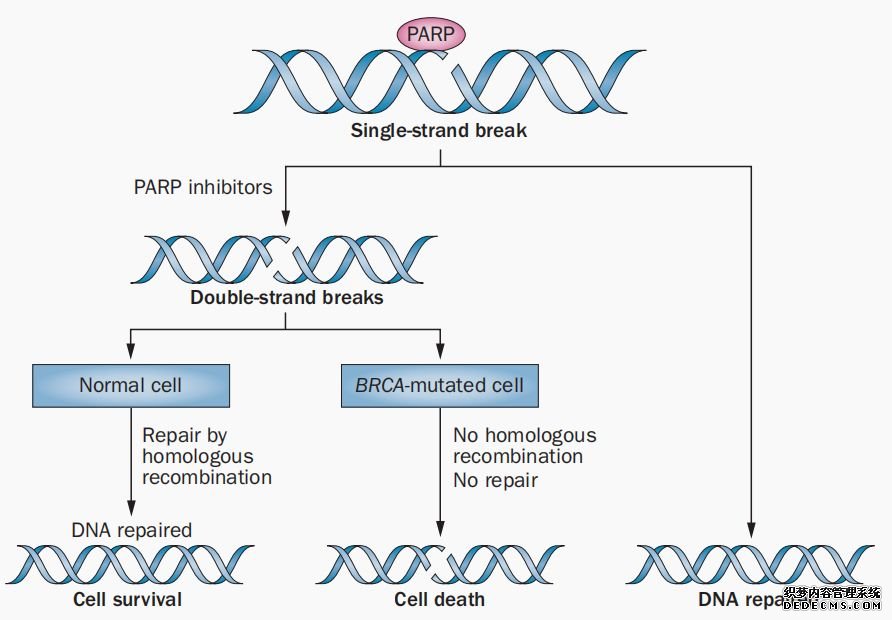
图片来源:文献[6],华医资本
这是什么意思呢,如前文所说,人体内的DDR(DNA Damage Repair)是非常精密的,当单链受损的时候,PARP酶作为断裂的分子传感器,参与单链修复(SSB),但是如果单链修复崩溃,则会引起双链修复(DSB)中的同源重组参与DNA修复,保证DNA修复功能。
但是如果同源重组修复功能也失效,那么基因组就会过度受损,会激活细胞固有的自杀信号。这就好像凡事都有个度,虽然基因组不稳定性推动了癌症的发展,但是癌症细胞也需要DDR功能来保持基因组一定的稳定性。
根据“合成致死”理论,由于PARP酶主要在单链上发挥作用,如果想要发挥PARP酶抑制剂的功效,就需要定位在双链修复功能缺失的患者上。双链修复(DSB)中的同源重组修复中一个比较常见的突变是BRCA基因缺陷。
研究表明作为PARP 抑制剂可以选择性杀伤由BRCA基因缺陷导致同源重组修复(homologous recombination repair, HR)功能缺陷的肿瘤细胞,而不影响 BRCA 基因功能正常细胞的存活[4,5]。
上述研究为BRCA突变型患者选择性靶向合成致死性治疗PARP抑制剂奠定了基础,由于BRCA的突变发生在乳腺癌、卵巢癌、胰腺癌中、前列腺癌等,一系列临床研究开始如火如荼的开展起来。
再后来,Thomas Helleday 等提出了 PARP 捕获理论[10,11],认为 PARP 抑制剂并不影响 PARP 酶与 DNA 损伤位点的结合,PARP 抑制剂抑制 PAR 聚合物形成造成 PARP 酶不能顺利脱离 DNA。
其结果是 PARP 抑制剂不仅抑制了 PARP 酶的催化作用,而且失活的PARP蛋白形成空间位阻,阻碍DNA修复相关蛋白发挥作用或者影响发生在 DNA 上的其它事件,例如复制。由此,使DNA单链修复失效,DNA损伤蓄积,杀伤细胞[10, 11]。
到了这一步,PARP抑制剂的作用机制已经越来越明确了,但是关于关于PARP 抑制剂的 PARP 酶活性抑制、PARP1-DNA 捕获以及细胞毒性三者之间的关系如何,以及 PARP 酶活性抑制在其中扮演何种角色仍需进一步阐明。
目前主流的观点认为,“捕获”PARP并把它“钉”在DNA上,才是PARP抑制剂消灭癌细胞的最大杀器【1,2,20】
做了PARP的基础介绍,接下来我们会从投资的角度来切入PARP抑制剂,回答三个问题,现在PARP抑制剂的临床进展如何?上市的PARP抑制剂中哪一类比较好?中国的PARP抑制剂竞争如何,投资价值如何?
现在PAPR抑制剂的临床进展如何?
图表4 :PARP抑制剂临床获批总结

图片来源:公开数据,华医资本整理
PARP抑制剂的临床进展是有目共睹的快,这一点可以从三个角度来看。一是适应症临床地位的攀升,二是临床患者的扩大(患者从BRCA突变向非BRCA突变患者拓展),三是临床适应症不断的扩展。这三点的突破无疑都在为PARP抑制剂开拓更多的适用人群。
临床地位攀升
首先从临床地位来看,2014年12月Olaparib FDA 获批上市晚期BRCA突变的卵巢癌患者适应症四线单药治疗,至2018年10 Olaparib FDA 携带BRCA突变(gBRCAm或sBRCAm)晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者一线维持治疗(PARP抑制剂第一次到一线地位)。
(背景介绍:由于卵巢癌是导致女性死亡的主要恶性肿瘤之一,约70%的卵巢癌患者在初诊时已为晚期。以铂类药物为基础的化疗是晚期卵巢癌患者的标准一线治疗,但经治后绝大多数(大约70%)患者会出现疾病复发并需要接受挽救性治疗。23%的卵巢癌与遗传相关,其中65%-85%的遗传性卵巢癌为BRCA1/2基因突变)。
在这项3期试验SOLO-1中试,在治疗经历一次化疗(完全或部分缓解)的391名携带BRCA突变卵巢癌患者的数据表明,Lynparza减少了70%的疾病进展和死亡风险。60%接受Lynparza治疗的患者在3年内没有疾病进展,而安慰剂组为27%。安慰剂组的中位无进展生存期(PFS)为13.8个月,而Lynparza组,在41月后仍有超过50%的患者没有疾病进展,尚未达到PFS中位数。
图表5 :SOLO-1实验结果
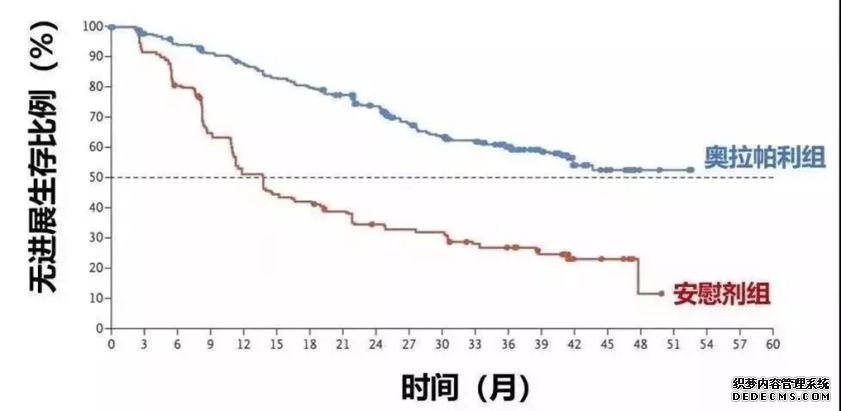
图片来源:公开数据,华医资本
临床患者扩大
BRCA的患者的效果好,但是BRCA的患者仍是少数,因此201703 Niraparib FDA批准上市用于接受铂类药物治疗后完全应答或部分应答但又复发的成人卵巢上皮癌、输卵管癌和原发性腹膜癌的二线维持治疗(无需检测BRCA基因型)可以认为是扩大临床需求的另外一个标志。它是首个无需考虑BRCA突变或其他同源重组缺陷状态, 扩宽了业界对于PARP抑制剂应用范围的认知。随后,奥拉帕利和芦卡帕利分别在2017年8月和2018年4月经美国FDA批准,获得了同样的适应症。
让我们来回顾下当时获批的临床实验数据:
NOVA的III期临床试验,员招募了500多名经铂类化疗后卵巢癌出现复发的患者,并根据生殖细胞是否带有BRCA基因突变,将患者分为了两组。相比于安慰剂,尼拉帕利使携带BRAC胚系(gBRCA)突变的患者的PFS从5.5个月一下子延长到21.0个月。非BRAC胚系(gBRCA)突变的患者中,同源重组缺陷阳性患者的PFS从3.8个月延长至12.9个月(图B);非的同源重组缺陷阳性的患者的PFS从3.9个月延长至9.3个月(图C)
图表6 :NOVAIII期实验结果
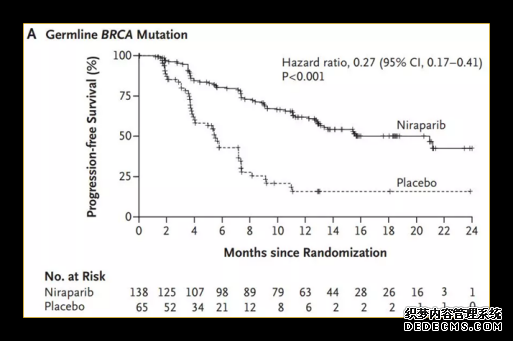
图片来源:公开数据,华医资本
临床适应症不断的扩展
2018年1月,Olaparib FDA获批用于既往已接受化疗治疗且携带胚系BRCA突变的HER2阴性转移性乳腺癌患者的治疗,这是第一款乳腺癌PARP抑制剂
2019年7月,奥拉帕尼 Olaparib 美国NCCN胰腺癌指南推荐加入胰腺癌—对有胚系BRCA1/2有害突变、转移性疾病、> 16周一线含铂化疗期间无疾病进展的患者一线维持治疗, 第一款胰腺癌PARP抑制剂获批,获批的临床数据中,虽然OS没有显著提升(18.9个月 VS 18.1个月),但是中位PFS对比安慰组为7.4个月 VS 3.8个月,对于提升患者的生活治疗效果还是很明显的。
另外目前关于前列腺癌、胃癌以及非小细胞肺癌的适应症也在临床中,以及和PD-L1和血管抑制剂的联用也在进行中。
上市的PARP抑制剂中哪一类好?
目前在临床的所有PARP抑制剂,都有一个与NAD+竞争结合PARP的烟酰胺部分。
图表7:烟酰胺及目前临床应用的 PARP 抑制剂的结构(红色部分为共通部分)
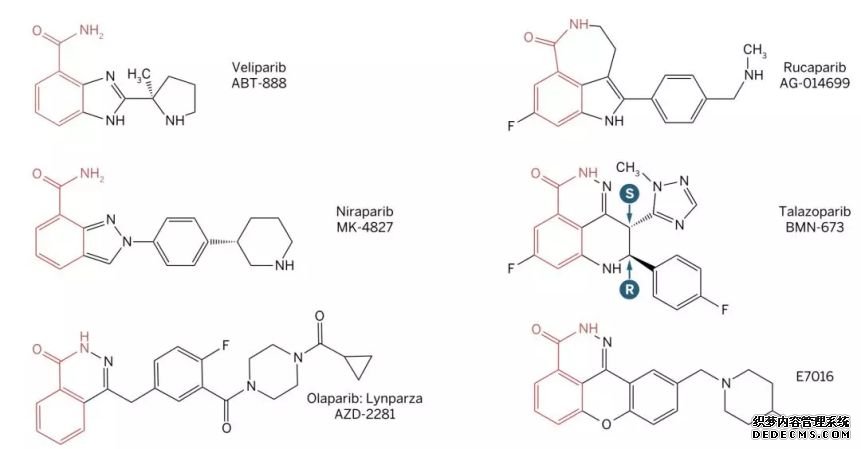
图片来源:公开数据,华医资本
根据上文提到的抑制剂机制,我们做了一个PARP抑制剂对比,尽管4个已上市药物的选择性(IC50)有差异,但是其药效和IC50的之间的关联,没有DNA trapping的差异性大,目前倾向于认为DNA Trapping 能力高的PARP抑制剂的细胞毒性更大【16】。
图表8:抑制剂之间的区别

图片来源:华医资本整理
那么是否DNA Trapping能力越好,就效果越好呢?由于没有头对头的临床实验,各个临床入组的患者又有区别,直接比较难对比,去年AACR做了一个对比,可以给予我们一定参考意义。
2018年美国癌症研究协会(AACR)年会上发布的一项临床前研究,头对头比较了几种主流PARP抑制剂的性质,试图从临床前研究中找到几种PARP抑制剂疗效相似、安全性不同的原因。结果发现奥拉帕利、卢卡帕利和尼拉帕利抑制PARP酶的活性、选择性以及DNA-PARP Trapping的活性都比较相似,也许这是它们疗效相似的原因。
但脱靶作用的对比,奥拉帕利的脱靶作用显著少于其他两种,尤其是尼拉帕利的脱靶效应比较明显,对多巴胺、5羟色胺和去甲肾上腺素转运体等靶点的作用较强,这可能和尼拉帕利高血压发生率更高有关。
图表9:AACR研究
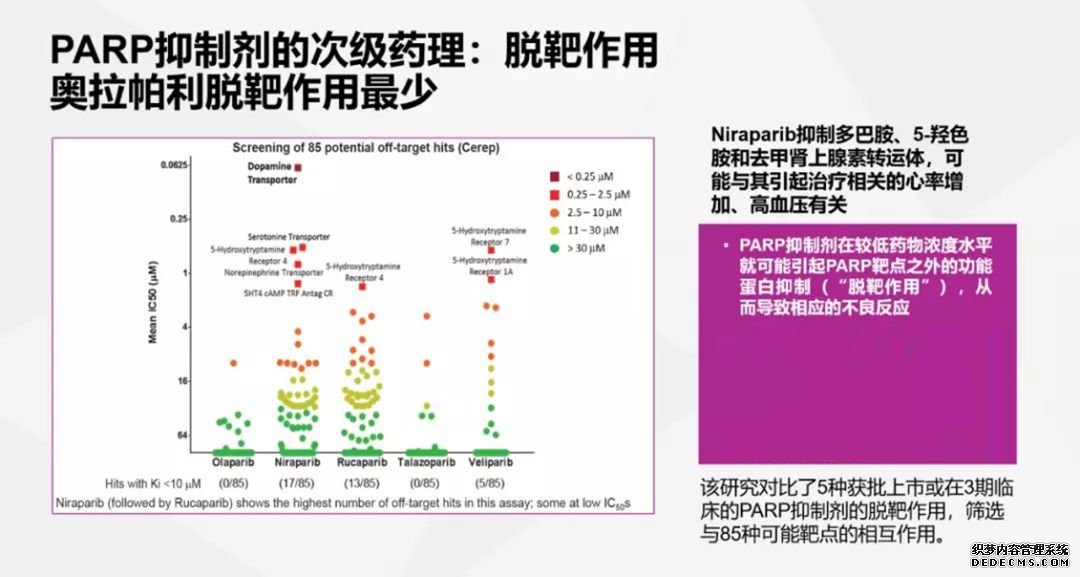
图片来源:公开资料
另外,这个研究对比了几种PARP抑制剂血液和骨髓分布的比例,发现奥拉帕利骨髓分布比例更少,尼拉帕利骨髓分布比例最高,这可能是尼拉帕利血液学毒性较强有关。
因此从AACR给出的临床前对比来看,几种PARP抑制剂的疗效相当(尽管剂量,IC50以及 DNA trapping 有差别),但是奥拉帕利脱靶效应最低,安全性佳。
另外,也参考了2019年美国妇科肿瘤年会Jonathan A Ledermann的发言,教授比较了奥拉帕尼、尼拉帕尼和雷卡帕尼的临床效果,(奥拉帕尼、尼拉帕尼和雷卡帕里都批了卵巢癌铂敏感复发患者含铂治疗后的维持治疗),从目前的经验来看,这三者的疗效(就二线维持)并无看出差异。
图表 10:2019年美国肿瘤年会Jonathan A Ledermnn发言1

图片来源:公开资料,华医资本
图表 11:2019年美国肿瘤年会Jonathan A Ledermnn发言2

图片来源:公开资料,华医资本
另外就副作用来看,还是由于没有头对头的试验,因此引用了临床试验的数据。虽然不好做直接比较,也可以侧面看出,尼拉帕尼的血液毒性相对于另外两个药物要强一些。
图表12:PARP抑制剂之间的和副作用相关的临床试验数据
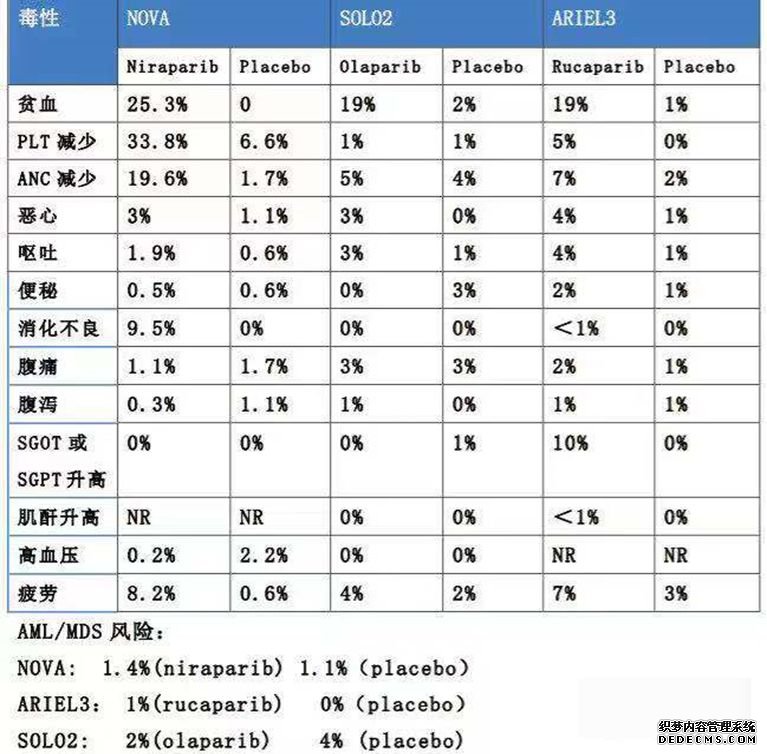
图片来源:公开资料,华医资本
因此整体上来看,目前国际主流观点认为这3种PARP抑制剂均能显著延长PFS、化疗间期等,疗效相似(针对二线维持),但安全性存在比较大的差异。目前来看,奥拉帕尼的安全性最高。(拉唑帕尼2018年上市,上市时间短,因为暂无查询到对比的数据等)。
所以总结来说,从分子结构上来说,怎么样的药物效果更好,目前很难下定论,还是需要以临床结果为导向。目前很难证实DNA TRAPPING的能力越好,就临床效果更好,因为 DNA trapping能力低,可以用更大的剂量去弥补,后面上市的三个药物也没有从临床疗效上赶超奥拉帕尼的征兆,目前来看依然是奥拉帕尼的安全性是最佳。
中国的PARP抑制剂竞争如何,投资价值如何?
目前国内药物竞争还不大,但是2-3年后竞争格局可能会发生很大改变。具体来说,2018年,奥拉帕尼进入中国,可以视为中国进入PARP抑制剂时代。不过就医药魔方数据显示,目前尼拉帕尼已经准备上市申请,豪森和百济神州在III期,瑛派在临床II期,因此前面几个key player是最具有竞争力的。
原研药的专利到期时间也是一个很重要的考虑因素。Rucaparib的核心专利于2020年过期,formulation的专利于2033左右过期,奥拉帕尼的核心专利于2024年过期,formulation的专利于2033过期。从药监官方数据查询,现还没有查到Rucaparib在中国仿制的临床报批,奥拉帕尼有一些仿制在申报临床。因此总体来说,专利保护力度肯定是下降的,在投资时这一点还需要再做进一步分析。
图表 13:中国PARP抑制剂临床进展

图片来源:医药魔方,华医资本
文献
【1】Pilié P G, Tang C, Mills G B, et al. State-of-the-art strategies for targeting the DNA damage response in cancer[J]. Nature Reviews Clinical Oncology, 2019, 16(2): 81-104. https://doi.org/10.1038/s41571-018-0114-z
【2】 Murai, J. et al. Trapping of PARP1 and PARP2 by clinical PARP inhibitors. Cancer Res. 72, 5588–5599 (2012).
【3】ShiobaraM, M M, ItoH, et al. Enhanced polyadenosine diphosphate-ribosylation in cirrhotic liver and carcinoma tissues in patients with hepatocellular carcinoma. Journal of Gastroenterology and Hepatology 2001; 16: 338-44.
【4】Farmer H, McCabe N, Lord CJ, et al. Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy. Nature 2005; 434: 917-20.
【5】Bryant HE, Schultz N, Thomas HD, et al. Specific killing of BRCA2-deficient tumours with inhibitors of poly(ADP-ribose) polymerase. Nature 2005; 434: 913-6.
【6】Sonnenblick A, de Azambuja E, Azim HA et al (2015) An update on PARP inhibitors–moving to the adjuvant setting. Nat Rev Clin Oncol. 12:27–41
【7】Murai J, Huang SY, Das BB, et al. Trapping of PARP1 and PARP2 by Clinical PARP Inhibitors. Cancer research 2012; 72: 5588-99.
【8】Murai J, Huang SY, Renaud A, et al. Stereospecific PARP trapping by BMN 673 and comparison with olaparib and rucaparib. Molecular cancer therapeutics 2014; 13: 433-43
【9】Shen Y, Aoyagi-Scharber M, Wang B. Trapping Poly(ADP-Ribose) Polymerase. Journal of pharmacology and experimental therapeutics 2015; 353: 446-57.
【10】elleday T. The underlying mechanism for the PARP and BRCA synthetic lethality: clearing up the misunderstandings. Molecular oncology 2011; 5: 387-93.
【11】Burkle A, Virag L. Poly(ADP-ribose): PARadigms and PARadoxes. Molecular Aspects of Medicine 2013; 34: 1046-65.
【12】Shen Y, Rehman FL, Feng Y, et al. BMN 673, a novel and highly potent PARP1/2 inhibitor for the treatment of human cancers with DNA repair deficiency. Clinical cancer research : an official journal of the American Association for Cancer Research 2013; 19: 5003-15.
【13】Yuan B, Ye N, Song SS, et al. Poly(ADP-ribose)polymerase (PARP) inhibition and anticancer activity of simmiparib, a new inhibitor undergoing clinical trials. Cancer Letters 2017; 386: 47-56
【14】Hopkins TA, Shi Y, Rodriguez LE, et al. Mechanistic Dissection of PARP1 Trapping and the Impact on In Vivo Tolerability and Efficacy of PARP Inhibitors. Molecular cancer research : MCR 2015; 13: 1465-77
【15】Curtin NJ. DNA repair dysregulation from cancer driver to therapeutic target[J]. Nat Rev Cancer, 2012, 12(12): 801-817. DOI:10.1038/nrc3399
【16】Lord C J, Ashworth A. PARP inhibitors: Synthetic lethality in the clinic[J]. Science, 2017, 355(6330): 1152-1158. DOI:10.1126/science.aam7344
【17】Murai J, Huang S Y, Das B B, et al. Trapping of PARP1 and PARP2 by Clinical PARP Inhibitors[J]. Cancer Research, 2012, 72(21): 5588-5599. DOI:10.1158/0008-5472.CAN-12-2753
【18】Murai J, Huang S N, Renaud A, et al. Stereospecific PARP trapping by BMN 673 and comparison with olaparib and rucaparib.[J]. Molecular Cancer Therapeutics, 2014, 13(2): 433-443. DOI:10.1158/1535-7163.MCT-13-0803
【19】Pommier Y, Oconnor M J, De Bono J S, et al. Laying a trap to kill cancer cells: PARP inhibitors and their mechanisms of action[J]. Science Translational Medicine, 2016, 8(362). DOI:10.1126/scitranslmed.aaf9246
【20】Ghosh R, Roy S, Kamyab J, et al. Common and unique genetic interactions of the poly(ADP-ribose) polymerases PARP1 and PARP2 with DNA double-strand break repair pathways.[J]. DNA Repair, 2016: 56-62. DOI:10.1016/j.dnarep.2016.06.001

